自查核查最新进度:现场核查目录中已有5产品获批!
发布时间:2016-10-25 来源:佚名
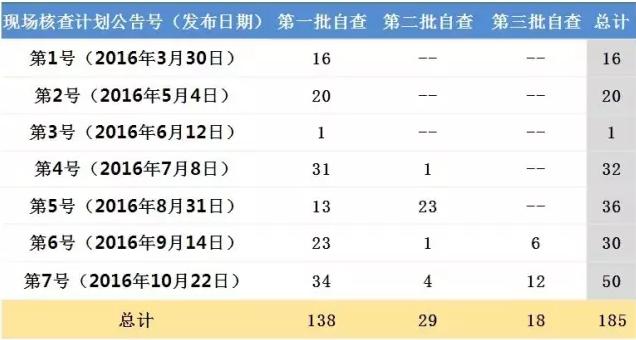
10月22日,药物临床试验数据现场核查计划第7号发布。不到7个月的时间,从2016年3月30日的第1号,到2016年10月22日的第7号,7批核查计划共涉及185个受理号。
笔者将这7批185个品种对应第一批自查品种(2015年7月22日公告,1622个)、第二批自查品种(2016年4月1日公告,181个)以及第三批自查品种(2016年9月1日公告,82个)进行深度分析。
近3个月第一批自查再无厂家撤回
2015年7月22日,CFDA发布的《关于开展药物临床试验数据自查核查工作的公告》要求申请人对申请上市和进口的1622个注册申请,即“第一批自查”的临床试验数据真实性、完整性、规范性进行自查。
对于第一批自查的1622个品种,扣除免临床试验的193个,需要进行自查的品种共计1429个。根据“食品药品监管总局药化注册司负责人谈新药临床数据核查”的数据,截至2016年6月底,企业经自查主动申请撤回了1193个,占应自查总数的83%。
对比CFDA历史公告,咸达数据V3.2发现,2015年8月28日第169号公告中主动撤回的注册申请317个;截至最近一次公告撤回的2016年3月1日第45号公告,企业主动撤回注册申请累计876个,正好1193个,与6月底的撤回数量一致。这表示自最后一次自查撤回公告以来连续3个月没有药品主动撤回。
这意味着企业的撤回基本已经定局,于是3月30日起CFDA食品药品审核查验中心开展药物临床试验数据现场核查计划。
现场核查不批准率或高于34%
按“食品药品监管总局药化注册司负责人谈新药临床数据核查”,实际上自2015年10月起,CFDA已开展核查,但并未建立核查前公布计划的制度(2016年3月前未公布过现场核查计划)。截至2016年9月底,CFDA共核查117个注册申请。
CFDA在2016年9月底以前对其中存在真实性问题的30个作出了不予批准的决定,约占应自查核查品种的2%;对涉嫌数据造假的27个品种11个临床试验机构和合同研究组织(CRO)予以立案调查。
那么,经过CFDA食品药品审核查验中心的药物临床试验数据现场核查后药品的不批准率到底有多高呢?
鉴于2016年药物临床试验数据现场核查计划公告(第6号)的公告期为2016年9月14日至2016年9月28日,这表示2016年9月底的核查应该是完成前5号现场核查计划公告的品种,亦即81个受理号。
咸达数据V3.2发现,2016年CFDA唯一一次公布的药品注册申请不予批准公告(2016年第92号“总局关于7家企业6个药品注册申请不予批准的公告”)中,没有一个受理号来自这81个受理号,而该公告公布的日期为4月29日,这表示所有不予批准的核查都在食品药品审核查验中心的药物临床试验数据现场核查计划第一次公告发布前已完成(第2号发布日期为5月4日))。
此外,药物临床试验数据现场核查计划的7次公告,每一次都有来自源于第一批自查的受理号,目前共涉及138个第一批自查的受理号,占第一批自查的8.5%。这意味着第一批自查的临床试验数据现场核查仍在进行。
第一批自查总共1622个受理号数,扣除临床试验的193个,再扣除企业经自查主动申请撤回的1193个,以及扣除2015年8月28日由于未提交自查资料也未主动撤回导致注册申请不予批准的受理号10个,预计最多226个产品面临临床核查。这226个品种中,再扣除138个进入药物临床试验数据现场核查计划公告第一批自查的受理号,剩下的受理号数即为现场核查计划公布制度未建立前接受现场核查的最大可能受理号数。将不批准的30个受理号数除以未建立前接受现场核查的最大可能受理号数,即可初步估计经过CFDA的现场核查后最终不予获批的比例,该比例不低于34%。
第二批、三批自查品种已启动现场核查
目前CFDA食品药品审核查验中心已公布7批药物临床试验数据现场核查计划,共涉及185个受理号。
2016年,CFDA分别在4月1日和9月1日公告需要进行临床试验数据自查核查的注册申请181个“第二批自查”受理号和82个“第三批自查”受理号。
自第4号药物临床试验数据现场核查计划起,都有来自于第二批自查受理号,目前共覆盖29个受理号,占第二批自查受理号数的15.9%。自第6号药物临床试验数据现场核查计划起,亦有第三批自查受理号出现,共18个受理号,占第二批自查受理号数的22.0%。
表1:现场核查计划对应的自查批次受理号情况
第1号、第2号现场核查目录已有产品获批
在现有7批现场核查的185个受理号中,53%是进口厂家的申报品种,然而暂无进口厂家产品获批。
2016年9月获批的中药和生物制品的新药都来自药物临床试验数据现场核查计划,现场核查计划公告(第1号)获得注册批号(新药证书)的比例为12.5%,现场核查计划公告(第2号)获批比例为15%。
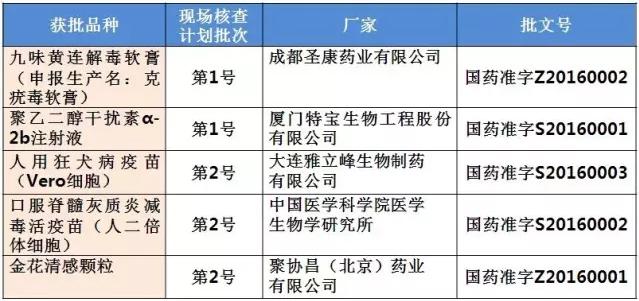
185个受理号最早的申报年可以追随到2005年,2006年和2007年的申报也各有1个。其中属于第一批自查名单的2006年成都圣康药业有限公司申报生产的克疣毒软膏在药物临床试验数据现场核查计划公告(第1号)中,并属于2016年CFDA公布的9月获批的药品批准文号名单,获批药品名为九味黄连解毒软膏(国药准字Z20160002)。
2006年申报生产的中药6类新药,经过10年临床核查还能过,这意味着历史久远的项目也是有可能获批。
同属于第一批自查名单和药物临床试验数据现场核查计划公告(第1号)中的厦门特宝生物工程股份有限公司的聚乙二醇干扰素α-2b注射液(国药准字S20160001)亦在9月获批。
药物临床试验数据现场核查计划公告(第2号)中的第一批自查也有受理号同样也是在2016年9月获批,为大连雅立峰生物制药有限公司的人用狂犬病疫苗(Vero细胞)(国药准字S20160003)、中国医学科学院医学生物学研究所的口服脊髓灰质炎减毒活疫苗(人二倍体细胞)(国药准字S20160002)和聚协昌(北京)药业有限公司的金花清感颗粒(国药准字Z20160001)。
表2:现场核查目录中已获批产品
结论>>>
2016年前三季度CFDA公布的新获批药品注册批文以化学药品原料药和注射剂为主,化药口服大多数还未开始审批。
一般而言,能够坚挺到等待CFDA的现场核查而不撤回的厂家通常对自己的项目较有信心,亦即市场和项目质量较好的项目。
9月中药和生物制品的新药获批,意味着药物临床试验数据现场核查的结论会逐步公开,并且大量好产品有望获批。






